A los átomos les gusta tener envolturas completas de electrones: es decir, les gusta hallarse en una situación en la que cada órbita esté llena. Por ejemplo, un átomo como el sodio, que tiene un electrón fuera de una capa llena, “desea” desprenderse de ese electrón. De la misma forma, el cloro, que tiene siete electrones (uno menos que el número necesario para llenar la órbita) en su capa externa, “desea” adquirir un electrón para llenarla.
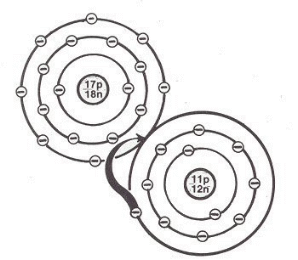
En el enlace iónico, un átomo cede un electrón y otro lo acepta. Por ejemplo, en la formación de la sal de mesa (cloruro de sodio), el sodio cede el electrón y el cloro lo toma. Debido a esta transferencia permanente de carga eléctrica, los dos átomos implicados se convierten en iones, es decir, cada uno tiene una carga eléctrica propia.
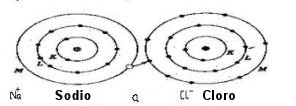
Así, existe una atracción electrostática entre esos dos átomos. Es esa atracción la que los mantiene unidos y la que, en último término, forma el material. Esta disposición recibe el nombre de enlace iónico. En general, los enlaces iónicos aparecen en los materiales inorgánicos y mantienen unidas cosas tales como rocas y cristales.
En el enlace covalente, un electrón es cambiado rápidamente de uno a otro lado entre dos átomos. En efecto, los átomos comparten el electrón, y este proceso de compartir sirve para mantener los átomos unidos.
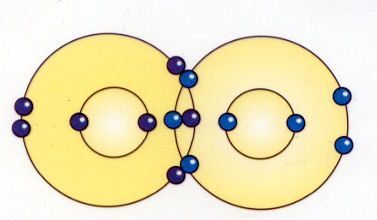
El átomo más común que forma enlaces covalentes es el carbono, que tiene cuatro electrones fuera de una envoltura completa. Casi todos los enlaces que mantienen juntos los materiales orgánicos son de este tipo. Los tejidos en nuestro cuerpo son mantenidos juntos principalmente por enlaces covalentes.
Un tipo vestigial de enlace iónico, llamado enlace de hidrógeno, es importante en muchos materiales. Funciona así: cuando el hidrógeno y el oxígeno se unen, normalmente forman un enlace covalente. El oxígeno, sin embargo, atrae a los electrones tan fuerte que tiende a tirar de ellos hacia sí, dejando la parte positiva del átomo de hidrógeno algo expuesta. Esta carga positiva expuesta puede entonces ejercer una fuerza eléctrica y atraer otros átomos.
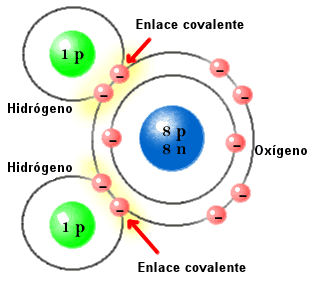
El efecto del enlace de hidrógeno es visto principalmente en el agua, donde la molécula tiene extremos cargados positiva y negativamente. Esta disposición permite a las moléculas de agua ejercer una fuerza eléctrica sobre otras moléculas, aunque el agua en sí no tiene carga eléctrica. Por eso resulta tan fácil para el agua atraer otros tipos de moléculas, y por eso el agua es el disolvente universal.
En un metal, todos los átomos se unen entre sí a través de un solo esfuerzo cooperativo, con cada átomo contribuyendo con uno o más electrones a la estructura general. Esos electrones flotan libremente por el material, de modo que un metal es una disposición de iones positivos pesados en un mar de electrones libres. En esencia, podemos pensar en el enlace metálico como la extensión lógica del enlace covalente: es un enlace en el que todos los átomos del material comparten todos los electrones, antes que tener que compartirlos por parejas.
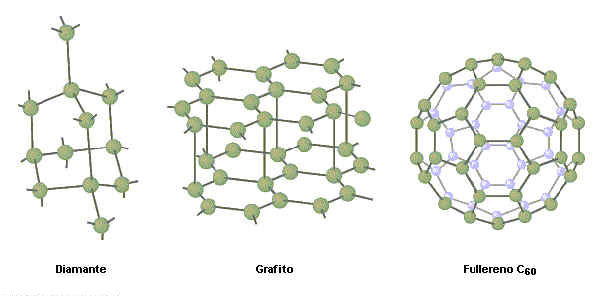
Los enlaces Van der Waals son la unión más débil en la cadena molecular. Llamados según el físico holandés Johannes D. van der Waals, la fuerza Van der Waals es generada de esta forma: cuando dos átomos se acercan uno a otro, la nube de electrones en un átomo tiende a repeler la nube de electrones en el otro. En efecto, esta repulsión empuja la nube de electrones lejos del núcleo en cada átomo. El resultado de esta distorsión mutua es una débil fuerza eléctrica entre los dos átomos.

Johannes Diderik van der Waals (1837-1923)
El que un material sea duro o blando, flexible o rígido, depende del tipo de enlaces que se produzcan en él. Por ejemplo, la madera es un material más bien rígido porque está formado por largas tiras de celulosa que se mantienen unidas por medio del enlace de hidrógeno. Podemos permanecer de pie sobre una roca y no caer a través de ella porque la roca es mantenida unida por enlaces iónicos, una de las fuerzas interatómicas más fuertes.
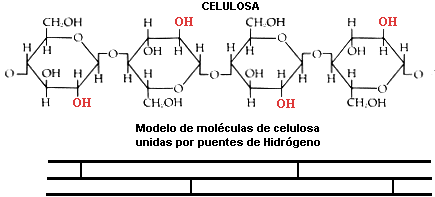

Celulosa
Podemos desmenuzar la arcilla con las manos porque la fuerza entre capas adyacentes de moléculas en la arcilla es del tipo Van der Waals. No importa cuál sea la propiedad del material, podemos comprenderla en términos de la forma en que los átomos son mantenidos juntos.

El que un material aparezca sólido, líquido o gaseoso depende de la forma en que sus moléculas se hallen unidas. Los tipos de enlaces químicos que acabamos de examinar aparecen primariamente en los sólidos, donde tienden a mantener los átomos en una estructura rígida. Si empujamos un átomo, la fuerza es transmitida a todos los demás, y todo el sólido se mueve.
En un líquido, por otra parte, las moléculas se hallan comprimidas juntas unas de otras pero no ligadas…, son como canicas en un saco. Empujar una molécula no fuerza a las demás a moverse.

En un gas, las moléculas se hallan ampliamente separadas y se mueven de un lado para otro como bolas de billar sobre una mesa, colisionando ocasionalmente pero en general interactuando sólo de una forma mínima unas con otras.
Puede pensarse en el plasma como en el cuarto estado de la materia. Cuando la temperatura de un gas es elevada lo suficiente, las colisiones entre átomos se convierten en los bastante violentas como para liberar a los electrones de sus núcleos. Esas colisiones dan como resultado un gas formado por electrones libres cargados negativamente y núcleos más pesados cargados positivamente. Este estado de la materia es un plasma. Los plasmas pueden hallarse (entre otros lugares) en las bombillas fluorescentes, televisores de plasma o en las estrellas.




YO ODIO LAS CIENCIAS JAJAJAJA
GRAX POR ESTA CASI NO LO ENCUENTRO